Seizoensgebonden griepepidemieën veroorzaken wereldwijd jaarlijks tussen de 290.000 en 650.000 sterfgevallen door luchtwegaandoeningen. Het land kampt deze winter met een ernstige grieppandemie na het einde van de COVID-19-pandemie. Griepvaccin is de meest effectieve manier om griep te voorkomen, maar het traditionele griepvaccin op basis van kippenembryocultuur kent enkele tekortkomingen, zoals immunogene variatie, productiebeperking, enzovoort.
De komst van een recombinant HA-eiwitgenengineering-griepvaccin kan de tekortkomingen van het traditionele kippenembryovaccin oplossen. Momenteel beveelt het American Advisory Committee on Immunization Practices (ACIP) een hooggedoseerd recombinant griepvaccin aan voor volwassenen ≥ 65 jaar. Voor mensen jonger dan 65 jaar beveelt de ACIP echter geen leeftijdsgeschikt griepvaccin aan als prioriteit vanwege het gebrek aan directe vergelijkingen tussen verschillende soorten vaccins.
Het quadrivalente recombinante hemagglutinine (HA) genetisch gemanipuleerde influenzavaccin (RIV4) is sinds 2016 in verschillende landen goedgekeurd voor marketing en is momenteel het meest gebruikte recombinante influenzavaccin. RIV4 wordt geproduceerd met behulp van een recombinant eiwittechnologieplatform, dat de tekortkomingen van de traditionele productie van geïnactiveerde vaccins, die beperkt worden door de voorraad kippenembryo's, kan overwinnen. Bovendien heeft dit platform een kortere productiecyclus, is het gunstiger voor de tijdige vervanging van kandidaat-vaccinstammen en kan het adaptieve mutaties vermijden die kunnen optreden in het productieproces van virale stammen die het beschermende effect van voltooide vaccins kunnen beïnvloeden. Karen Midthun, destijds directeur van het Center for Biologics Review and Research bij de Amerikaanse Food and Drug Administration (FDA), merkte op dat "de komst van recombinante influenzavaccins een technologische vooruitgang vertegenwoordigt in de productie van influenzavaccins... Dit biedt de mogelijkheid voor een snellere start van de vaccinproductie in geval van een uitbraak"[1]. Bovendien bevat RIV4 drie keer zoveel hemagglutinine-eiwit als het conventionele griepvaccin in de standaarddosis, dat een sterkere immunogeniciteit heeft [2]. Bestaande studies hebben aangetoond dat RIV4 een betere bescherming biedt dan het griepvaccin in de standaarddosis bij ouderen, en er is meer volledig bewijs nodig om de twee vaccins bij jongere populaties te vergelijken.
Op 14 december 2023 publiceerde het New England Journal of Medicine (NEJM) een studie van Amber Hsiao et al., Kaiser Permanente Vaccine Study Center, KPNC Health System, Oakland, VS. De studie is een praktijkstudie waarbij een gerandomiseerde populatiebenadering werd gebruikt om het beschermende effect van RIV4 te evalueren ten opzichte van een quadrivalent geïnactiveerd influenzavaccin met standaarddosis (SD-IIV4) bij mensen jonger dan 65 jaar tijdens twee griepseizoenen van 2018 tot en met 2020.
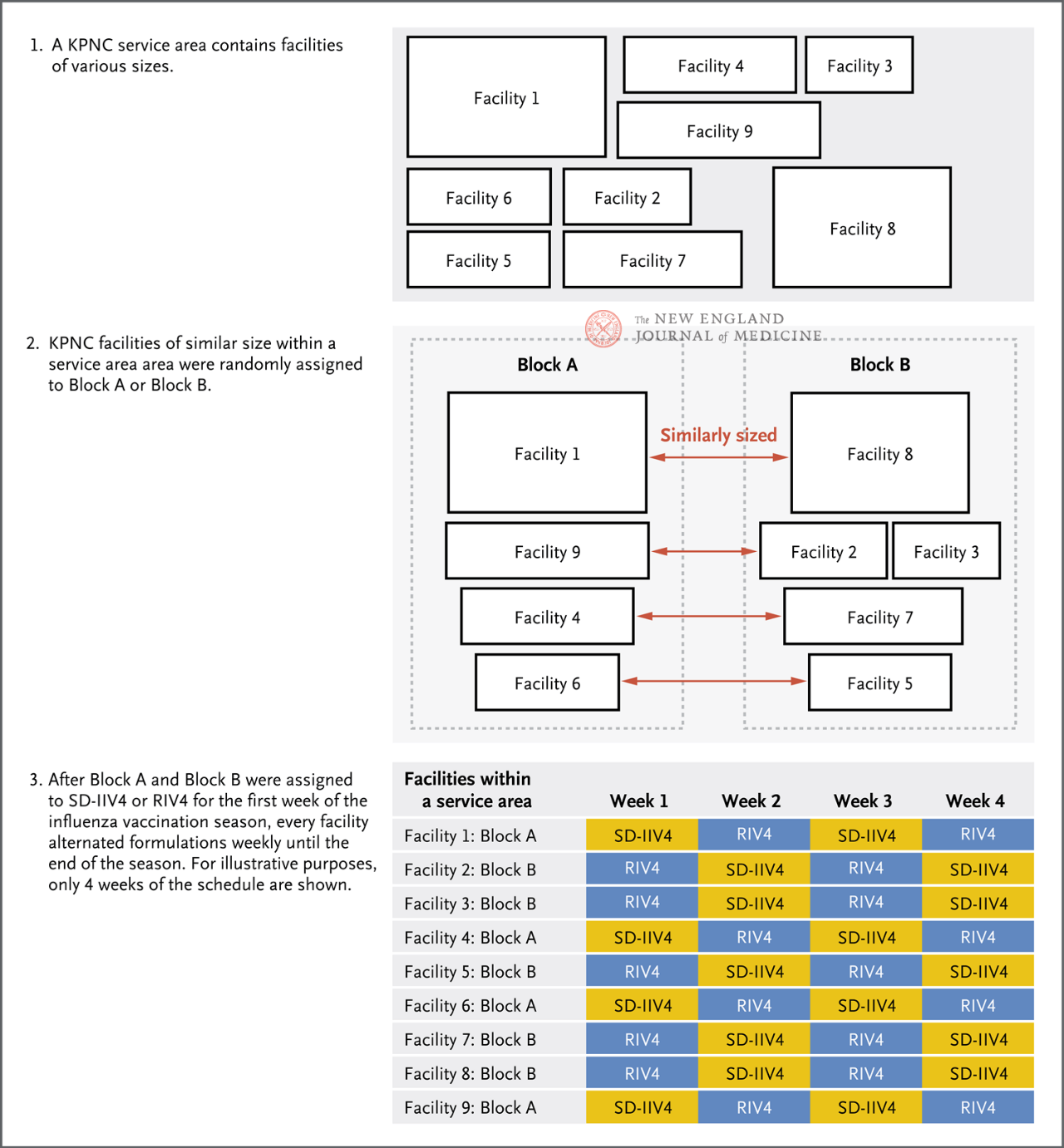
Afhankelijk van het verzorgingsgebied en de grootte van de KPNC-faciliteiten werden ze willekeurig toegewezen aan groep A of groep B (figuur 1). Groep A kreeg in de eerste week RIV4, groep B kreeg in de eerste week SD-IIV4 en vervolgens kreeg elke faciliteit afwisselend wekelijks de twee vaccins tot het einde van het huidige griepseizoen. Het primaire eindpunt van de studie was PCR-bevestigde influenzagevallen, en secundaire eindpunten omvatten influenza A, influenza B en influenzagerelateerde ziekenhuisopnames. Artsen in elke faciliteit voeren naar eigen goeddunken influenza PCR-tests uit, op basis van de klinische presentatie van de patiënt, en verkrijgen diagnoses van klinische en poliklinische patiënten, laboratoriumtests en vaccinatiegegevens via elektronische medische dossiers.
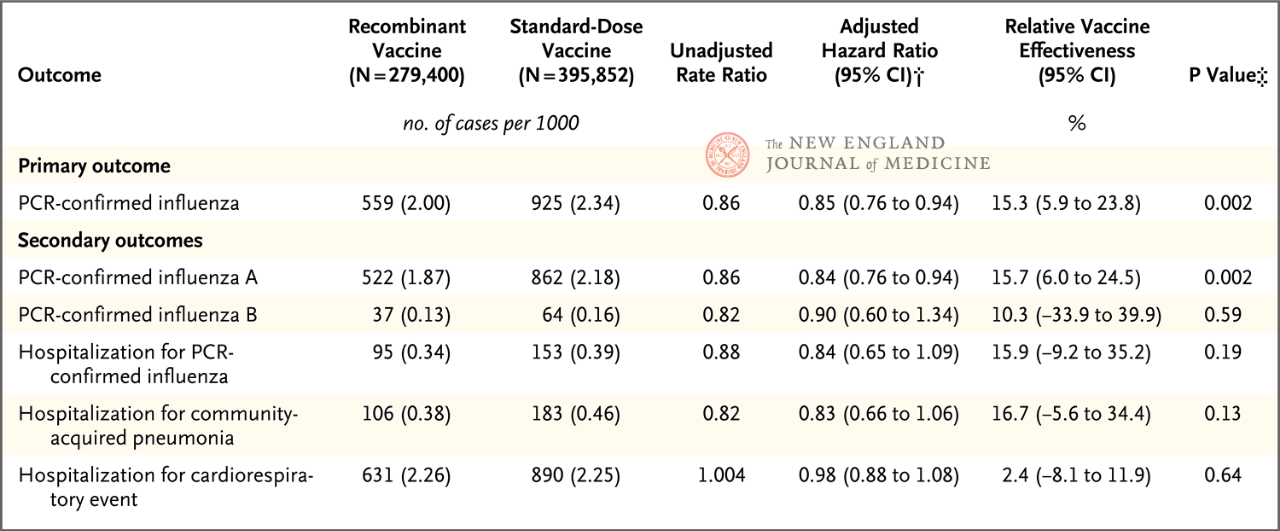
De studie omvatte volwassenen van 18 tot 64 jaar, waarbij 50 tot 64 jaar de primaire geanalyseerde leeftijdsgroep was. De resultaten toonden aan dat het relatieve beschermende effect (rVE) van RIV4 vergeleken met SD-IIV4 tegen PCR-bevestigde influenza 15,3% was (95% BI, 5,9-23,8) bij mensen van 50 tot 64 jaar. De relatieve bescherming tegen influenza A was 15,7% (95% BI, 6,0-24,5). Er werd geen statistisch significant relatief beschermend effect aangetoond voor influenza B of influenza-gerelateerde ziekenhuisopnames. Bovendien lieten exploratieve analyses zien dat bij mensen van 18-49 jaar, zowel voor influenza (rVE, 10,8%; 95% BI, 6,6-14,7) als influenza A (rVE, 10,2%; 95% BI, 1,4-18,2), RIV4 een betere bescherming bood dan SD-IIV4.
Een eerdere gerandomiseerde, dubbelblinde, positief gecontroleerde klinische werkzaamheidsstudie toonde aan dat RIV4 een betere bescherming bood dan SD-IIV4 bij mensen van 50 jaar en ouder (rVE, 30%; 95% BI, 10~47) [3]. Deze studie toont opnieuw aan de hand van grootschalige praktijkgegevens aan dat recombinante influenzavaccins een betere bescherming bieden dan traditionele geïnactiveerde vaccins, en vult het bewijs aan dat RIV4 ook een betere bescherming biedt bij jongere populaties. De studie analyseerde de incidentie van infectie met het respiratoir syncytieel virus (RSV) in beide groepen (RSV-infectie zou in beide groepen vergelijkbaar moeten zijn omdat influenzavaccin RSV-infectie niet voorkomt), sloot andere verstorende factoren uit en verifieerde de robuustheid van de resultaten door middel van meervoudige gevoeligheidsanalyses.
De nieuwe, in deze studie toegepaste, gerandomiseerde groepsopzet, met name de wekelijkse afwisselende vaccinatie van het experimentele vaccin en het controlevaccin, bracht de interfererende factoren tussen de twee groepen beter in evenwicht. Vanwege de complexiteit van het ontwerp zijn de eisen voor de uitvoering van het onderzoek echter hoger. In deze studie resulteerde een onvoldoende voorraad recombinant influenzavaccin in een groter aantal mensen dat RIV4 had moeten krijgen, dat SD-IIV4 kreeg, wat resulteerde in een groter verschil in het aantal deelnemers tussen de twee groepen en een mogelijk risico op bias. Bovendien was de studie oorspronkelijk gepland voor uitvoering van 2018 tot 2021, en de opkomst van COVID-19 en de bijbehorende preventie- en bestrijdingsmaatregelen hebben zowel de studie als de intensiteit van de influenza-epidemie beïnvloed, waaronder de verkorting van het influenzaseizoen 2019-2020 en de afwezigheid van het influenzaseizoen 2020-2021. Er zijn slechts gegevens beschikbaar van twee ‘abnormale’ griepseizoenen van 2018 tot en met 2020. Er is dus meer onderzoek nodig om te beoordelen of deze bevindingen standhouden in meerdere seizoenen, bij verschillende circulerende stammen en bij verschillende componenten van het vaccin.
Al met al bewijst deze studie verder de haalbaarheid van recombinante, genetisch gemanipuleerde vaccins die worden toegepast op het gebied van griepvaccins, en legt het tevens een solide technische basis voor toekomstig onderzoek en de ontwikkeling van innovatieve griepvaccins. Het technologieplatform voor recombinante, genetisch gemanipuleerde vaccins is niet afhankelijk van kippenembryo's en biedt de voordelen van een korte productiecyclus en een hoge productiestabiliteit. Vergeleken met traditionele, geïnactiveerde griepvaccins biedt het echter geen significant voordeel op het gebied van bescherming, en is het moeilijk om het fenomeen van immuunontsnapping, veroorzaakt door sterk gemuteerde griepvirussen, bij de wortel aan te pakken. Net als bij traditionele griepvaccins zijn stamvoorspelling en antigeenvervanging jaarlijks vereist.
Gezien de opkomst van influenzavarianten moeten we in de toekomst nog steeds aandacht besteden aan de ontwikkeling van universele influenzavaccins. De ontwikkeling van een universeel griepvaccin zou de bescherming tegen virusstammen geleidelijk moeten uitbreiden en uiteindelijk in verschillende jaren effectieve bescherming tegen alle stammen moeten bereiken. Daarom moeten we in de toekomst het ontwerp van breedspectrumimmunogenen op basis van HA-eiwit blijven bevorderen, ons richten op NA, een ander oppervlakte-eiwit van het influenzavirus, als een belangrijk doelwit voor vaccins, en ons richten op respiratoire immunisatietechnologieën die voordeliger zijn in het induceren van multidimensionale beschermende reacties, waaronder lokale cellulaire immuniteit (zoals neussprayvaccin, inhaleerbaar droogpoedervaccin, enz.). Blijf het onderzoek naar mRNA-vaccins, dragervaccins, nieuwe adjuvantia en andere technische platforms bevorderen en de ontwikkeling realiseren van ideale universele influenzavaccins die "op alle veranderingen reageren zonder verandering".
Plaatsingstijd: 16-12-2023