Cachexie is een systemische ziekte die wordt gekenmerkt door gewichtsverlies, atrofie van spier- en vetweefsel en systemische ontstekingen. Cachexie is een van de belangrijkste complicaties en doodsoorzaken bij kankerpatiënten. Naast kanker kan cachexie worden veroorzaakt door diverse chronische, niet-kwaadaardige aandoeningen, waaronder hartfalen, nierfalen, chronische obstructieve longziekte (COPD), neurologische aandoeningen, aids en reumatoïde artritis. De incidentie van cachexie bij kankerpatiënten kan naar schatting oplopen tot 25% tot 70%, wat de kwaliteit van leven (QOL) van de patiënt ernstig aantast en de behandelingsgerelateerde toxiciteit verergert.
Effectieve interventie bij cachexie is van groot belang voor het verbeteren van de kwaliteit van leven en de prognose van kankerpatiënten. Ondanks enige vooruitgang in het onderzoek naar de pathofysiologische mechanismen van cachexie, zijn veel medicijnen die zijn ontwikkeld op basis van mogelijke mechanismen slechts gedeeltelijk effectief of ineffectief. Er is momenteel geen effectieve behandeling goedgekeurd door de Amerikaanse Food and Drug Administration (FDA).
Er zijn vele redenen voor het mislukken van klinische studies naar cachexie, en de fundamentele reden zou kunnen liggen in het gebrek aan grondig begrip van het mechanisme en het natuurlijke beloop van cachexie. Onlangs publiceerden professor Xiao Ruiping en onderzoeker Hu Xinli van het College of Future Technology van de Universiteit van Peking gezamenlijk een artikel in Nature Metabolism, waarin de belangrijke rol van de melkzuur-GPR81-route bij het ontstaan van kankercachexie werd onthuld, wat een nieuw idee bood voor de behandeling van cachexie. We vatten dit samen door artikelen uit Nat Metab, Science, Nat Rev Clin Oncol en andere tijdschriften samen te vatten.
Gewichtsverlies wordt meestal veroorzaakt door een verminderde voedselinname en/of een verhoogd energieverbruik. Eerdere studies hebben gesuggereerd dat deze fysiologische veranderingen bij tumorgerelateerde cachexie worden aangestuurd door bepaalde cytokinen die worden afgescheiden door de tumormicro-omgeving. Factoren zoals groeidifferentiatiefactor 15 (GDF15), lipocaline-2 en insuline-achtig proteïne 3 (INSL3) kunnen bijvoorbeeld de voedselinname remmen door zich te binden aan eetlustregulerende plaatsen in het centrale zenuwstelsel, wat leidt tot anorexia bij patiënten. IL-6, PTHrP, activine A en andere factoren stimuleren gewichtsverlies en weefselatrofie door de katabole route te activeren en het energieverbruik te verhogen. Momenteel richt onderzoek naar het mechanisme van cachexie zich voornamelijk op deze afgescheiden eiwitten, en slechts enkele studies hebben de associatie tussen tumormetabolieten en cachexie onderzocht. Professor Xiao Ruiping en onderzoeker Hu Xinli hebben een nieuwe benadering gekozen om het belangrijke mechanisme van tumorgerelateerde cachexie te onthullen vanuit het perspectief van tumormetabolieten.
Ten eerste screende het team van professor Xiao Ruiping duizenden metabolieten in het bloed van gezonde controlegroepen en muizen met longkankercachexie. Ze ontdekten dat melkzuur de meest significant verhoogde metaboliet was bij muizen met cachexie. De serummelkzuurspiegel steeg met de tumorgroei en vertoonde een sterke correlatie met de gewichtsverandering van muizen met tumoren. Serummonsters van longkankerpatiënten bevestigen dat melkzuur ook een belangrijke rol speelt in de progressie van kankercachexie bij mensen.
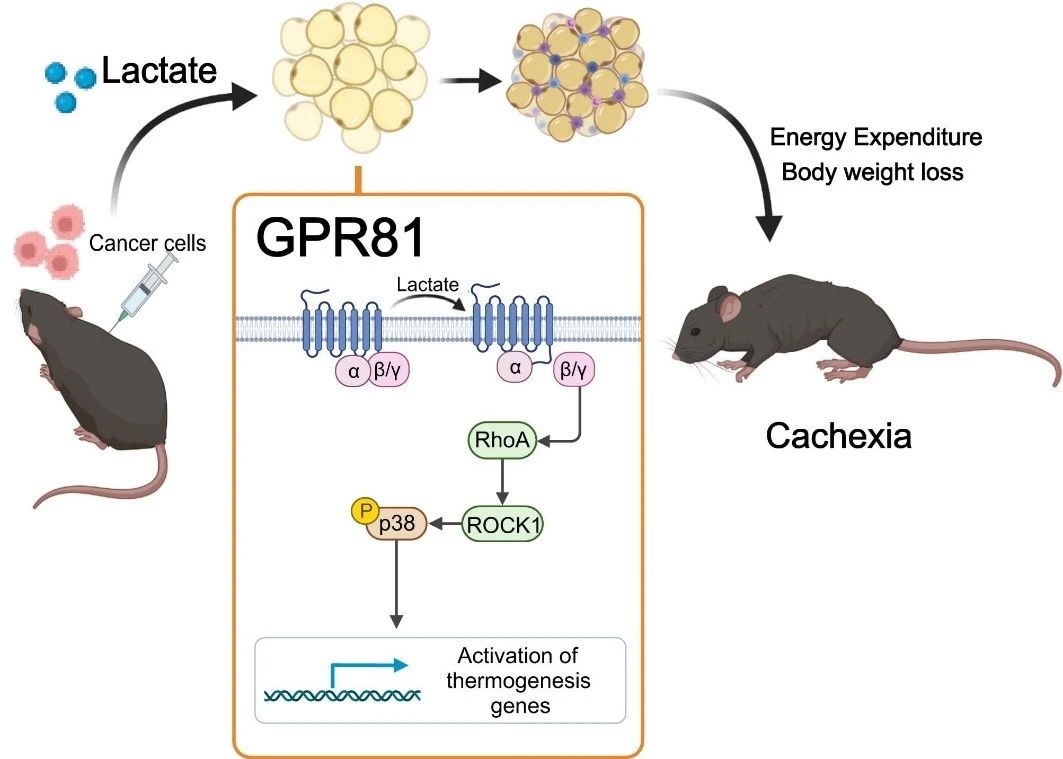
Om te bepalen of hoge melkzuurspiegels cachexie veroorzaken, bracht het onderzoeksteam melkzuur in het bloed van gezonde muizen via een onderhuidse osmotische pomp. Hierdoor werd de serummelkzuurspiegel kunstmatig verhoogd tot het niveau van muizen met cachexie. Na twee weken ontwikkelden de muizen een typisch cachexiefenotype, zoals gewichtsverlies, vet- en spierweefselatrofie. Deze resultaten suggereren dat lactaat-geïnduceerde vetremodellering vergelijkbaar is met die geïnduceerd door kankercellen. Lactaat is niet alleen een karakteristieke metaboliet van kankercachexie, maar ook een belangrijke mediator van kanker-geïnduceerd hyperkatabole fenotypes.
Vervolgens ontdekten ze dat deletie van de lactaatreceptor GPR81 effectief was in het verlichten van tumor- en serumlactaat-geïnduceerde cachexieverschijnselen zonder de serumlactaatspiegels te beïnvloeden. Omdat GPR81 sterk tot expressie komt in vetweefsel en veranderingen in vetweefsel eerder optreden dan in skeletspieren tijdens de ontwikkeling van cachexie, is het specifieke knock-outeffect van GPR81 in muizenvetweefsel vergelijkbaar met dat van systemische knock-out, met verbetering van tumorgeïnduceerd gewichtsverlies en vet- en skeletspierverbruik. Dit suggereert dat GPR81 in vetweefsel nodig is voor de ontwikkeling van kankercachexie veroorzaakt door melkzuur.
Uit verder onderzoek bleek dat melkzuurmoleculen na binding aan GPR81 zorgen voor vervetting, lipolyse en verhoogde systemische warmteproductie via de Gβγ-RhoA/ROCK1-p38-signaalroute in plaats van via de klassieke PKA-route.
Ondanks veelbelovende resultaten in de pathogenese van kankergerelateerde cachexie, hebben deze bevindingen zich nog niet vertaald in effectieve behandelingen. Daarom zijn er momenteel geen behandelstandaarden voor deze patiënten. Sommige verenigingen, zoals ESMO en de European Society of Clinical Nutrition and Metabolism, hebben echter wel klinische richtlijnen ontwikkeld. Momenteel bevelen internationale richtlijnen sterk aan om de stofwisseling te bevorderen en katabolisme te verminderen door middel van benaderingen zoals voeding, lichaamsbeweging en medicatie.
Plaatsingstijd: 28-04-2024