Tegenwoordig is niet-alcoholische leververvetting (NAFLD) de belangrijkste oorzaak van chronische leverziekte in China en zelfs wereldwijd. Het ziektespectrum omvat eenvoudige hepatische steatohepatitis, niet-alcoholische steatohepatitis (NASH) en gerelateerde cirrose en leverkanker. NASH wordt gekenmerkt door overmatige vetophoping in hepatocyten en geïnduceerde celschade en ontsteking, met of zonder leverfibrose. De ernst van leverfibrose bij NASH-patiënten hangt nauw samen met een slechte leverprognose (cirrose en de bijbehorende complicaties en hepatocellulair carcinoom), cardiovasculaire voorvallen, extrahepatische maligniteiten en overlijden door welke oorzaak dan ook. NASH kan de kwaliteit van leven van patiënten negatief beïnvloeden; er zijn echter nog geen medicijnen of therapieën goedgekeurd voor de behandeling van NASH.
Uit een recent onderzoek (ENLIVEN) dat is gepubliceerd in het New England Journal of Medicine (NEJM) is gebleken dat pegozafermin zowel leverfibrose als leverontsteking verbeterde bij patiënten met niet-cirrotische NASH die door middel van biopsie waren bevestigd.
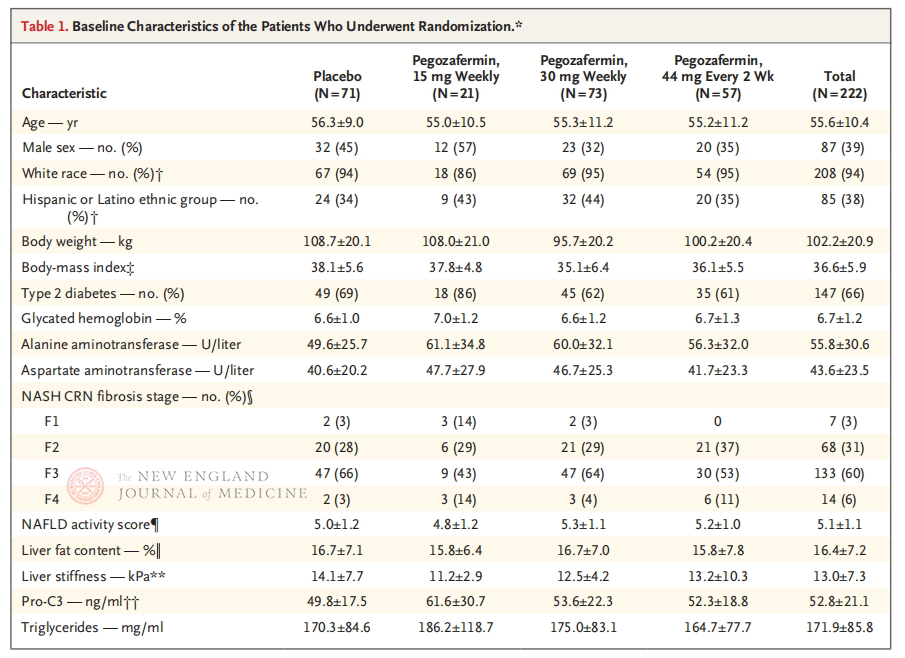
De multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde fase 2b klinische studie, uitgevoerd door professor Rohit Loomba en zijn klinische team aan de University of California, San Diego School of Medicine, omvatte 222 patiënten met biopsie-bevestigde NASH in stadium F2-3 tussen 28 september 2021 en 15 augustus 2022. Ze werden willekeurig toegewezen aan pegozafermin (subcutane injectie, 15 mg of 30 mg eenmaal per week, of 44 mg eenmaal per twee weken) of placebo (eenmaal per week of eenmaal per twee weken). Primaire eindpunten waren ≥ stadium 1 verbetering van fibrose en geen progressie van NASH. NASH verdween zonder fibrotische progressie. De studie voerde ook een veiligheidsbeoordeling uit.
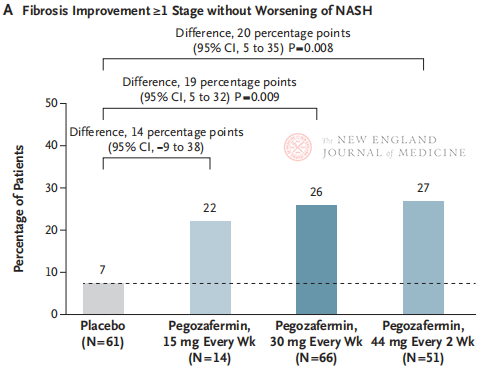
Na 24 weken behandeling was het percentage patiënten met ≥ stadium 1 verbetering van fibrose en geen verergering van NASH, en het percentage patiënten met regressie van NASH en geen verergering van fibrose, significant hoger in de drie pegozafermin-dosisgroepen dan in de placebogroep, met significantere verschillen tussen patiënten die werden behandeld met 44 mg eenmaal per twee weken of 30 mg eenmaal per week. Qua veiligheid was pegozafermin vergelijkbaar met placebo. De meest voorkomende bijwerkingen geassocieerd met pegozaferminbehandeling waren misselijkheid, diarree en erytheem op de injectieplaats. De voorlopige resultaten van deze fase 2b-studie suggereren dat behandeling met pegozafermin de leverfibrose verbetert.
Pegozafermin, gebruikt in deze studie, is een langwerkend geglycoliseerd analoog van humane fibroblastgroeifactor 21 (FGF21). FGF21 is een endogeen metabolisch hormoon dat door de lever wordt afgescheiden en een rol speelt bij de regulering van het lipiden- en glucosemetabolisme. Eerdere studies hebben aangetoond dat FGF21 therapeutische effecten heeft op NASH-patiënten door de insulinegevoeligheid van de lever te verhogen, de vetzuuroxidatie te stimuleren en de lipogenese te remmen. De korte halfwaardetijd van natuurlijk FGF21 (ongeveer 2 uur) beperkt echter het gebruik ervan bij de klinische behandeling van NASH. Pegozafermin maakt gebruik van geglycosyleerde pegylatietechnologie om de halfwaardetijd van natuurlijk FGF21 te verlengen en de biologische activiteit ervan te optimaliseren.
Naast de positieve resultaten in deze fase 2b klinische studie, toonde een andere recente studie gepubliceerd in Nature Medicine (ENTRIGUE) aan dat pegozafermin ook de triglyceriden, niet-HDL-cholesterol, apolipoproteïne B en leververvetting aanzienlijk verlaagde bij patiënten met ernstige hypertriglyceridemie, wat een positief effect kan hebben op het verminderen van het risico op cardiovasculaire voorvallen bij patiënten met NASH.
Deze studies suggereren dat pegozafermin, als endogeen metabolisch hormoon, meerdere metabole voordelen kan bieden aan patiënten met NASH, vooral omdat NASH in de toekomst mogelijk zal worden omgedoopt tot metabolisch geassocieerde leververvetting. Deze resultaten maken het een zeer belangrijk potentieel geneesmiddel voor de behandeling van NASH. Tegelijkertijd zullen deze positieve onderzoeksresultaten de toelating van pegozafermin tot fase 3 klinische studies ondersteunen.
Hoewel zowel de tweewekelijkse behandeling met 44 mg als de wekelijkse behandeling met 30 mg pegozafermin het histologische primaire eindpunt van de studie bereikte, bedroeg de behandelingsduur in deze studie slechts 24 weken en het therapietrouwpercentage in de placebogroep slechts 7%, wat significant lager was dan de resultaten van eerdere klinische studies van 48 weken. Zijn de verschillen en de veiligheid hetzelfde? Gezien de heterogeniteit van NASH zijn in de toekomst grotere, multicenter, internationale klinische studies nodig om grotere patiëntenpopulaties te omvatten en de behandelingsduur te verlengen om de werkzaamheid en veiligheid van het geneesmiddel beter te kunnen evalueren.
Plaatsingstijd: 16-09-2023